Anonymous
0
0
Giáo án Hóa 10 Bài 16 (Chân trời sáng tạo 2024): Các yếu tố ảnh hưởng đến tốc độ phản ứng hoá học
- asked 6 months agoVotes
0Answers
0Views
Giáo án Hóa 10 Bài 16 (Chân trời sáng tạo): Các yếu tố ảnh hưởng đến tốc độ phản ứng hoá học (3 tiết)
I. MỤC TIÊU
1. Năng lực chung
- Tự chủ và tự học: Chủ động, tích cực tìm hiểu về nhiệt động học của phản ứng, ý nghĩa và tìm hiểu ứng dụng của các yếu tố ảnh hưởng đến tốc độ phản ứng trong đời sống, sản xuất.
- Giao tiếp và hợp tác: Sử dụng ngôn ngữ khoa học để diễn đạt về các yếu tố ảnh hưởng đến tốc độ phản ứng; Hoạt động nhóm hiệu quả theo đúng yêu cầu của GV, đảm bảo các thành viên trong nhóm đều được tham gia và trình bày báo cáo; Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân.
- Giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm, liên hệ thực tiễn nhằm giải quyết các vấn đề trong bài học và cuộc sống.
2. Năng lực hoá học
- Nhận thức hoá học: Giải thích được các yếu tố ảnh hướng tới tốc độ phản ứng như: nồng độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác; Nêu được ý nghĩa của hệ số nhiệt độ Van't Hoff (γ).
- Tìm hiểu thế giới tự nhiên dưới góc độ hoá học: Tiến hành được thí nghiệm nghiên cứu các yếu tố ảnh hưởng tới tốc độ phản ứng như: nổng độ, diện tích bề mặt, chất xúc tác.
- Vận dụng kiến thức, kĩ năng đã học: Vận dụng được kiến thức tốc độ phản ứng hoá học vào việc giải thích một số vấn đề trong cuộc sống và sản xuất.
3. Phẩm chất
- Cẩn thận, trung thực, trách nhiệm và thao tác an toàn trong quá trinh làm thực nghiệm.
- Có niềm say mê, hứng thú với việc khám phá và học tập bộ môn hoá học.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Giáo viên
-Hình ảnh vềảnh hưởng của nồng độ, nhiệt độ, áp suất, diện tích bề mặt tiếp xúc đến tốc độ phản ứng.
- Mô phỏng ảnh hưởng của áp suất, nồng độ, nhiệt độ đến tốc độ phản ứng.
- Dụng cụ và hóa chất: (6 bộ/ lớp):
+ Hóa chất: dung dịch sodium thiosulfate (Na2S2O3) 0,15 M, sulfuric acid (H2SO4) 0,10 M, dung dịch HC1 1 M, đá vôi (CaCO3) dạng khối và dạng hạt nhỏ, nước cất, dung dịch hydrogen peroxide (H2O2) 30%, bột MnO2.
+ Dụng cụ và thiết bị: 3 cốc thuỷ tinh 100 mL (được đánh dấu thập ở mặt ngoài đáy cốc), ống đong 50 mL, 2 cốc thủy tinh, bình tam giác 100 mL, cân, 2 ống nghiệm, tàn đóm đỏ.
- Phiếu học tập.
2. Học sinh
Ôn tập bài cũ và chuẩn bị bài mới.
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
a. Mục tiêu
- Tạo hứng thú và kích thích sự tò mò của học sinh vào chủ đề học tập. Học sinh tiếp nhận kiến thức chủ động, tích cực, hiệu quả.
b.Nội dung:
- GV sử dụng câu hỏi mở đầu SGK – Hoá học 10 trang 98 để đặt vấn đề vào bài mới.
c. Sản phẩm: Câu trả lời của học sinh, câu trả lời có thể đúng hoặc sai.
d. Tổ chứcthực hiện
- GV đặt vấn đề: HS quan sát các hình ảnh sau:

Thực phẩm bảo quản trong tủ lạnh sẽ giữ được lâu hơn, khi nấu một loại thực phẩm bằng nồi áp suất sẽ nhanh chín hơn, bệnh nhân sẽ dễ hô hấp hơn khi dùng oxygen từ bình chứa khí oxygen so với từ không khí,…
Những yếu tố nào ảnh hưởng đến tốc độ của các quá trình biến đổi trên?
- HS trả lời.
- GV không nhận xét tính đúng sai ở câu trả lời của HS, mà sử dụng nó để dẫn vào bài mới: “Vậy có những yếu tố nào ảnh hưởng đến tốc độ phản ứng hoá học, để kiểm soát tốc độ các phản ứng diễn ra trong đời sống, sản xuất người ta vận dụng các yếu tố này như thế nào? Sau đây cô sẽ cùng các em tìm hiểu trong bài học ngày hôm nay.”
B. HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Tìm hiểu về ảnh hưởng của nồng độ đến tốc độ phản ứng
a. Mục tiêu:
- Giải thích được yếu tố nồng độ ảnh hướng tới tốc độ phản ứng.
-Thực hiện thí nghiệm nghiên cứu ảnh hưởng của nhiệt độ đến tốc độ phản ứng.
b.Nội dung: HS làm việc theo nhóm, làm thí nghiệm và hoàn thiện phiếu học tập số 1:
PHIẾU HỌC TẬP 1
*Tiến hành thí nghiệm 1:
Bước 1: Pha loãng dung dịch Na2S2O3 0,15 M để được các dung dịch có nồng độ khác nhau theo bảng:
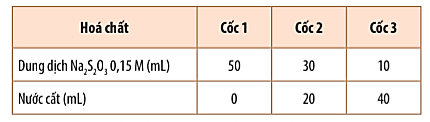
Bước 2: Rót đổng thời 10 mL dung dịch H2SO4 0,1 M vào mỗi cốc và khuấy đều.
Phương trình hoá học của phản ứng:
Na2S2O3(aq) + H2SO4(aq) → Na2SO4(aq) + S(s) + SO2(g) + H2O(l)
*Hiện tượng của thí nghiệm:
* Nhận xét mối liên hệ giữa thể tích dung dịch Na2S2O3 với thời gian xuất hiện kết tủa:
* Giải thích kết quả thí nghiệm:
c. Sản phẩm
- Các câu trả lời của HS:
TRẢ LỜI PHIẾU HỌC TẬP 1
*Tiến hành thí nghiệm 1:
Bước 1: Pha loãng dung dịch Na2S2O3 0,15 M để được các dung dịch có nồng độ khác nhau theo bảng:
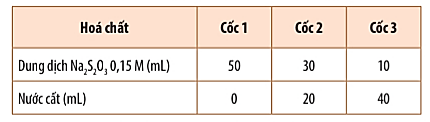
Bước 2: Rót đổng thời 10 mL dung dịch H2SO4 0,1 M vào mỗi cốc và khuấy đều.
Phương trình hoá học của phản ứng:
Na2S2O3(aq) + H2SO4(aq) → Na2SO4(aq) + S(s) + SO2(g) + H2O(l)
*Hiện tượng của thí nghiệm:
Khi rót dung dịch H2SO4 vào cốc đựng dung dịch Na2S2O3 theo trình tự từ cốc 1 đến cốc 3, cốc 1 có lượng S tạo ra nhiều làm mờ dấu thập nhanh nhất, chậm dần ở các cốc còn lại.
* Nhận xét mối liên hệ giữa thể tích dung dịch Na2S2O3 với thời gian xuất hiện kết tủa:
Thể tích của dung dịch Na2S2O3 0,15M càng giảm, xuất hiện kết tủa càng chậm.
* Giải thích kết quả thí nghiệm:
Nồng độ Na2S2O3 giảm ⇒ Số va chạm hiệu quả giữa các phân tử Na2S2O3 và phân tử H2SO4 giảm ⇒ Kết tủa tạo thành chậm tức là tốc độ phản ứng chậm hơn.
d. Tổ chứcthực hiện
HOẠT ĐỘNG CỦA GIÁO VIÊN |
HOẠT ĐỘNG CỦA HỌC SINH |
Bước 1: Chuyển giao nhiệm vụ học tậpChia lớp thành 6 nhóm Yêu cầu học sinh hoạt động nhóm thực hiện nội dung phiếu học tập số 1. |
Nhận nhiệm vụ |