Anonymous
0
0
Chuyên đề Hóa 12 Bài 7 (Cánh diều): Liên kết và cấu tạo của phức chất
- asked 6 months agoVotes
0Answers
0Views
Giải Chuyên đề Hóa 12 Bài 7: Liên kết và cấu tạo của phức chất
Mở đầu trang 43 Chuyên đề Hóa học 12:Bằng thực nghiệm, người ta xác định được cấu tạo của phức chất [NiCl4]2-như hình bên. Hãy cho biết:
a) Dạng hình học của phức chất.
b) Thuyết liên kết hóa trị giải thích dạng hình học của phức chất [NiCl4]2- như thế nào?
Lời giải:
a) Dạng hình học của phức chất là: dạng tứ diện.
b) Thuyết liên kết hóa trị giải thích dạng hình học của phức chất [NiCl4]2- như sau:
Phức chất có điện tích là -2, mỗi ion Cl− có điện tích là -1 nên điện tích của nguyên tử trung tâm là +2.
Cấu hình electron của ion Ni2+ là: [Ar]3d84s04p0.
Cấu hình electron hoá trị dạng ô orbital của Ni2+ là:
Cation Ni2+ sử dụng 1 orbital 4s trống và 3 orbital 4p trống để lai hoá sp3, tạo nên 4 orbital lai hoá trống.
Mỗi anion Cl- cho mỗi orbital lai hoá trống của cation Ni2+ một cặp electron chưa liên kết để hình thành một liên kết cho – nhận.
I. Liên kết và cấu tạo phức chất theo thuyết liên kết hoá trị
Câu hỏi trang 44 Chuyên đề Hóa học 12:Xác định điện tích của nguyên tử trung tâm trong phức chất [Cd(NH3)4]2+
Lời giải:
Phức chất có điện tích là +2, mỗi phân tử NH3 trung hoà về điện (có điện tích là 0), vậy điện tích của nguyên tử trung tâm là +2.
Luyện tập 1 trang 45 Chuyên đề Hóa học 12:Thực nghiệm xác nhận phức chất [Zn(NH3)4]2+có dạng hình học tứ diện. Giải thích sự tạo thành liên kết và mô tả cấu tạo phức chất này theo thuyết Liên kết hóa trị.
Lời giải:
Thuyết liên kết hóa trị giải thích dạng hình học của phức chất [Zn(NH3)4]2+ như sau:
Phức chất có điện tích là +2, mỗi phân tử NH3 trung hoà về điện (có điện tích là 0), vậy điện tích của nguyên tử trung tâm là +2.
Cấu hình electron của ion Zn2+ là: [Ar]3d104s04p0.
Cấu hình electron hoá trị dạng ô orbital của Zn2+ là:
Cation Zn2+ sử dụng 1 orbital 4s trống và 3 orbital 4p trống để lai hoá sp3, tạo nên 4 orbital lai hoá trống.
Mỗi phân tử NH3 cho mỗi orbital lai hoá trống của cation Zn2+ một cặp electron chưa liên kết để hình thành một liên kết cho – nhận.
Luyện tập 2 trang 45 Chuyên đề Hóa học 12:Thực nghiệm xác nhận phức chất [FeF6]4-có dạng hình học bát diện. Giải thích sự tạo thành liên kết và mô tả cấu tạo phức chất này theo thuyết Liên kết hóa trị.
Lời giải:
Phức chất có điện tích là -4, mỗi ion F− có điện tích là -1 nên điện tích của cation nguyên tử trung tâm là +2.
Cấu hình electron của Fe2+: [Ar]3d64s04p0.
Cấu hình electron hoá trị dạng ô orbital của Fe2+ là:
Cation Fe2+ sử dụng 1 orbital 4s trống, 3 orbital 4p trống và 2 orbital 4d trống để lai hoá sp3d2, tạo nên 6 orbital lai hoá trống.
Mỗi ion F− cho mỗi orbital lai hoá trống của cation Fe2+ một cặp electron chưa liên kết để hình thành 1 liên kết cho – nhận.
II. Dạng hình học của phức chất
Luyện tập 3 trang 46 Chuyên đề Hóa học 12:Theo thực nghiệm, phức chất [Fe(CN)6]3-có dạng hình học bát diện. Hãy vẽ dạng hình học của phức chất này.
Lời giải:
Dạng hình học của phức chất [Fe(CN)6]3- :
Luyện tập 4 trang 46 Chuyên đề Hóa học 12:Theo thực nghiệm, phức chất [Cd(NH3)4]2+có dạng hình học tứ diện. Hãy vẽ dạng hình học của phức chất này.
Lời giải:
Dạng hình học của phức chất: [Cd(NH3)4]2+
III. Đồng phân phức chất
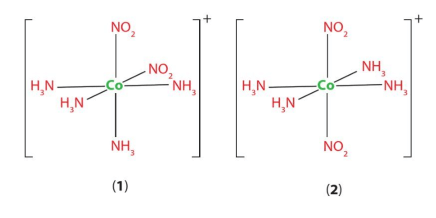
Luyện tập 5 trang 46 Chuyên đề Hóa học 12:Chỉ ra đồng phân cis và trans của phức chất bát diện [CoCl2(NH3)4]+ở Hình 7.3.
Lời giải:
Ta có:
+ Ở đồng phân cis, hai phối tử giống nhau ở cùng một phía so với nguyên tử trung tâm.
+ Ở đồng phân trans, hai phối tử giống nhau ở hai phía so với nguyên tử trung tâm.
Vậy: (I) là đồng phân trans; (II) là đồng phân cis.
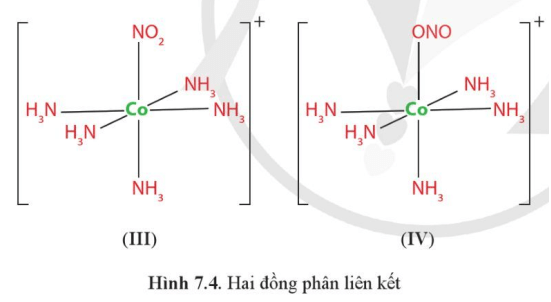
Luyện tập 6 trang 47 Chuyên đề Hóa học 12:Vì sao nguyên tử N và một nguyên tử O trong anion NO2−đều có thể tạo liên kết cho – nhận với nguyên tử trung tâm như trong phức chất (III) hoặc (IV)?
Lời giải:
Nguyên tử N và một nguyên tử O trong anion NO2− đều có thể tạo liên kết cho – nhận với nguyên tử trung tâm như trong phức chất (III) hoặc (IV) vì nguyên tử N hay O trong anion NO2− đều có thể cho vào orbital trống của nguyên tử Co2+ cặp electron liên kết.
Luyện tập 7 trang 48 Chuyên đề Hóa học 12:Hãy cho biết hai phức chất dưới đây có phải là đồng phân của nhau không. Giải thích.
[PtCl2(NH3)4]Br2 và [PtBr2(NH3)4]Cl2
Lời giải:
Hai phức chất [PtCl2(NH3)4]Br2 và [PtBr2(NH3)4]Cl2 là đồng phân ion hoá do chúng có cùng thành phần nhưng có sự hoán đổi vị trí của anion ở ngoài dấu móc vuông và trong dấu móc vuông.
Bài tập (trang 48)
Bài tập 1 trang 48 Chuyên đề Hóa học 12:Phức chất [CoCl4]2-có dạng hình học tứ diện. Giải thích sự tạo thành liên kết và vẽ dạng hình học của phức chất này theo thuyết Liên kết hóa trị.
Lời giải:
- Giải thích sự tạo thành liên kết trong phức chất [CoCl4]2-:
Phức chất có điện tích là -2, mỗi ion Cl− có điện tích là -1 nên điện tích của nguyên tử trung tâm là +2.
Cấu hình electron của ion Co2+ là: [Ar]3d74s04p0.
Cấu hình electron hoá trị dạng ô orbital của Co2+ là:
Cation Co2+ sử dụng 1 orbital 4s trống và 3 orbital 4p trống để lai hoá sp3, tạo nên 4 orbital lai hoá trống.
Mỗi anion Cl- cho mỗi orbital lai hoá trống của cation Co2+ một cặp electron chưa liên kết để hình thành một liên kết cho – nhận.
- Dạng hình học của phức chất [CoCl4]2- theo thuyết Liên kết hóa trị:
Bài tập 2 trang 48 Chuyên đề Hóa học 12:Phức chất [Co(OH2)6]2+có dạng hình học bát diện. Giải thích sự tạo thành liên kết và vẽ dạng hình học của phức chất này theo thuyết Liên kết hóa trị.
Lời giải:
- Giải thích sự tạo thành liên kết trong phức chất [Co(OH)6]2+:
Phức chất có điện tích là +2, mỗi phân tử H2O có điện tích là 0 (trung hoà về điện) nên điện tích của nguyên tử trung tâm là +2.
Cấu hình electron của ion Co2+ là: [Ar]3d74s04p0.
Cấu hình electron hoá trị dạng ô orbital của Co2+ là:
Cation Co2+ sử dụng 1 orbital 4s trống, 3 orbital 4p trống và 2 orbital 4d trống để lai hoá sp3d2, tạo nên 6 orbital lai hoá trống.
Mỗi phân tử H2O cho mỗi orbital lai hoá trống của cation Co2+ một cặp electron chưa liên kết để hình thành 1 liên kết cho – nhận.
- Dạng hình học của phức chất [Co(OH)6]2+:
Bài tập 3 trang 48 Chuyên đề Hóa học 12:Chỉ ra dạng cis và dạng trans trong hai đồng phân dưới đây:
Lời giải:
Ta có:
+ Ở đồng phân cis, hai phối tử giống nhau ở cùng một phía so với nguyên tử trung tâm.
+ Ở đồng phân trans, hai phối tử giống nhau ở hai phía so với nguyên tử trung tâm.
Vậy: (1) là đồng phân cis; (2) là đồng phân trans;
![Bằng thực nghiệm người ta xác định được cấu tạo của phức chất [NiCl4]2 như hình bên](https://vietjack.com/chuyen-de-hoa-12/images/mo-dau-trang-43-chuyen-de-hoa-hoc-12-cd.PNG)
![Bằng thực nghiệm người ta xác định được cấu tạo của phức chất [NiCl4]2 như hình bên](https://vietjack.com/chuyen-de-hoa-12/images/mo-dau-trang-43-chuyen-de-hoa-hoc-12-cd-2.PNG)
![Thực nghiệm xác nhận phức chất [Zn(NH3)4]2 có dạng hình học tứ diện. Giải thích](https://vietjack.com/chuyen-de-hoa-12/images/luyen-tap-1-trang-45-chuyen-de-hoa-hoc-12-cd.PNG)
![Thực nghiệm xác nhận phức chất [FeF6]4 có dạng hình học bát diện. Giải thích](https://vietjack.com/chuyen-de-hoa-12/images/luyen-tap-2-trang-45-chuyen-de-hoa-hoc-12-cd.PNG)
![Theo thực nghiệm phức chất [Fe(CN)6]3 có dạng hình học bát diện. Hãy vẽ dạng hình học](https://vietjack.com/chuyen-de-hoa-12/images/luyen-tap-3-trang-46-chuyen-de-hoa-hoc-12-cd.PNG)
![Theo thực nghiệm phức chất [Cd(NH3)4]2 có dạng hình học tứ diện. Hãy vẽ dạng hình học](https://vietjack.com/chuyen-de-hoa-12/images/luyen-tap-4-trang-46-chuyen-de-hoa-hoc-12-cd.PNG)
![Chỉ ra đồng phân cis và trans của phức chất bát diện [CoCl2(NH3)4] ở Hình 7.3](https://vietjack.com/chuyen-de-hoa-12/images/luyen-tap-5-trang-46-chuyen-de-hoa-hoc-12-cd.PNG)
![Phức chất [CoCl4]2 có dạng hình học tứ diện. Giải thích sự tạo thành liên kết](https://vietjack.com/chuyen-de-hoa-12/images/bai-tap-1-trang-48-chuyen-de-hoa-hoc-12-cd.PNG)
![Phức chất [CoCl4]2 có dạng hình học tứ diện. Giải thích sự tạo thành liên kết](https://vietjack.com/chuyen-de-hoa-12/images/bai-tap-1-trang-48-chuyen-de-hoa-hoc-12-cd-2.PNG)
![Phức chất [Co(OH2)6]2 có dạng hình học bát diện. Giải thích sự tạo thành liên kết](https://vietjack.com/chuyen-de-hoa-12/images/bai-tap-2-trang-48-chuyen-de-hoa-hoc-12-cd.PNG)
![Phức chất [Co(OH2)6]2 có dạng hình học bát diện. Giải thích sự tạo thành liên kết](https://vietjack.com/chuyen-de-hoa-12/images/bai-tap-2-trang-48-chuyen-de-hoa-hoc-12-cd-2.PNG)